喜讯|我司FIC新药ZSP1601片治疗NASH患者Ib/IIa期临床试验获得积极结果
近日,众生睿创FIC新药ZSP1601片治疗非酒精性脂肪性肝炎(NASH)的Ib/Ⅱa期临床试验(CTR20200207,NCT04140123)于2021年8月完成了最后一例受试者的末次访视。
主要研究者牛俊奇院长和丁艳华主任在吉林大学第一医院I期药物临床试验病房进行试验揭盲,并获得了顶线(Top Line)分析数据。初步试验结果分析表明,ZSP1601治疗NASH患者28天后,表现出良好的耐受性与安全性。
对探索性药效学终点评估表明,ZSP1601片中、高剂量组可改善肝脏炎性和损伤甚至纤维化相关生物标志物,试验结果良好,达到了研究目的。基于ZSP1601片获得积极的Ib/Ⅱa期临床试验结果,众生睿创将组织实施ZSP1601片用于治疗非酒精性脂肪性肝炎患者的Ⅱb期临床试验。

组长单位研究者牛俊奇院长和丁艳华教授对试验进行揭盲
一、关于ZSP1601
ZSP1601片是具有全新作用机制和全球自主知识产权的用于治疗NASH的一类创新药物,属于First-in-class药物,为境内首个进入临床试验用于治疗NASH的创新药物。
临床前多个NASH动物药效模型研究结果表明,ZSP1601可改善肝组织炎症、水样变性和坏死,以及改善纤维化,其强效抗肝纤维化作用是该领域治疗的最重要关注点,未来可能成为NASH联合用药治疗的基石药物。
ZSP1601片在NASH患者中多中心、随机、双盲、安慰剂对照的Ib/Ⅱa期临床试验的主要研究目的是评价ZSP1601片在NASH患者中的安全性、耐受性、药代动力学特征和早期药效学。本研究由吉林大学第一医院牛俊奇教授、丁艳华教授作为主要研究者,参加单位包括南方医科大学南方医院和首都医科大学附属北京友谊医院。目前已完成了ZSP1601片Ib/Ⅱa期临床研究入组及顶线数据初步分析工作。
二、临床研究的安全性、药代动力学和初步有效性结果呈现
试验纳入了基线时磁共振质子密度脂肪含量(MRI-PDFF)≥10%且ALT≥1.5倍正常值上限的NASH患者。共随机入组37例,接受给药36例。临床研究的安全性、药代动力学和初步有效性结果如下:
(一)安全性方面
ZSP1601组和安慰剂组的不良事件发生率分别为77.8%(21/27)和 66.7%(6/9)。大多数不良事件为1级或2级,无严重不良事件发生,未发生导致死亡的不良事件,无因不良事件停止研究用药或退出研究的情况发生。本研究试验组和安慰剂组间的不良事件、不良反应、3级不良事件差异均无统计学意义,初步表明ZSP601片在NASH患者中具有良好的安全性和耐受性。
(二)药代动力学方面
NASH 患者连续口服ZSP1601片28天,在50mg QD、50mg BID和100mg BID 三个剂量组下,血浆暴露量随剂量增加呈递增的趋势。服药后约1.5~2.5小时达到峰值,半衰期约9小时,Ib/IIa期的药代动力学特征基本与Ia期结果相符。
(三)有效性方面
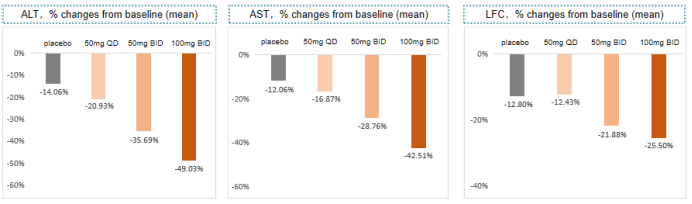
研究表明, ALT或AST作为关键的肝损伤生物标志物,转氨酶的降低可反应NASH 组织学的改善。本研究中,基于全分析集,ZSP1601片治疗28天后,安慰剂组、50mg QD组、50mg BID组和100mg BID组ALT分别较基线下降13.55U/L、24.80U/L、38.94U/L和55.06U/L,其中50mg BID组和100mg BID组与安慰剂组相比差异有统计学意义(P=0.0225和P=0.0003)。
各组ALT较基线相对变化率分别为-14.06%、-20.93%、-35.69%和-49.03%,各组在第7~43天中,ALT恢复正常的例数分别为1例(11.1%)、1例(11.1%)、2例(22.2%)、4例(44.4%);与安慰剂组相比,100mg BID组AST在第7~43天绝对变化和变化百分比均值均最大,下降趋势明显,第22、29天,与安慰剂相比差异有统计学意义(P=0.0098和P=0.0115)。
此外,初步的疗效探索还发现,ZSP1601片50 mg BID组、100 mg BID组在肝脏脂肪含量(LFC)、肝脏受控衰减参数(Fibroscan-CAP)、胰岛素抵抗分数(HOMA-IR)、肝纤维化指数(FIB4)、天冬氨酸氨基转移酶和血小板比率(APRI)、细胞角蛋白18(CK-18)等一个或多个指标均有下降趋势,且下降趋势较安慰剂组更明显;同时,与安慰剂组相比,ZSP1601片各剂量组并不升高血清低密度脂蛋白胆固醇水平或甘油三酯水平。顶线数据初步表明,ZSP1601片中高剂量组在NASH患者中,可改善肝脏炎性和损伤的相关生物标志物,试验结果良好。
三、研究者及公司领导寄语
本研究主要研究者吉林大学第一医院牛俊奇教授表示:目前尚无有效的NASH治疗手段,国内外均没有批准可用于治疗NASH的药物上市。很多被寄予厚望的药物在II期和III期临床试验中由于未达到疗效终点而宣告失败。ZSP1601早期临床研究在28天的治疗下明显地降低了ALT、AST等肝脏炎症损伤标志物,提示其具有改善肝脏炎症、坏死的潜力,在更长的治疗周期中或可表现出抗纤维化的作用,令人期待。另外,在此次多中心试验中,采用MRI-PDFF评估疗效指标肝脏脂肪含量,我们建立了规范的操作指南,采用第三方盲态阅片,为后续临床研究打下了基础。作为国内首创First-in-Class治疗NASH的新药,ZSP1601获得的积极结果更是鼓舞着我们继续在NASH领域探索,继续创新实践,发出中国声音。
